5月2日����,東誠藥業(yè)集團下屬公司藍納成新加坡子公司收到美國食品藥品監(jiān)督管理局核準簽發(fā)的關(guān)于18F-LNC1007注射液的藥品臨床試驗批準通知書����,將于近期在澳大利亞開展I期臨床試驗。
關(guān)于18F-LNC1007注射液
01公司在研產(chǎn)品18F-LNC1007注射液是一種新型雙靶點放射性體內(nèi)診斷藥物�����,同時靶向成纖維細胞活化蛋白(Fibroblast Activation Protein�����,以下簡稱“FAP”)和整合素αvβ3 (Integrin αvβ3�����,以下簡稱“αvβ3”)�����,擬用于診斷FAP和αvβ3陽性的成人實體瘤�����。
02FAP為II型跨膜絲氨酸蛋白酶�����,高表達于許多上皮腫瘤相關(guān)成纖維細胞(Cancer-Associated Fibroblasts�����,簡稱“CAF”)中�����,包括胃癌、食管癌����、肺癌、結(jié)直腸癌����、卵巢癌等,而在正常組織����、良性腫瘤間質(zhì)中無表達或表達較低。αvβ3是位于細胞表面的異源二聚體受體����,在正常血管內(nèi)皮和上皮細胞很少表達,但在肺癌����、骨肉瘤、成神經(jīng)細胞瘤����、乳腺癌、前列腺癌����、膀胱癌、膠質(zhì)母細胞瘤及浸潤性黑色素瘤等多種實體腫瘤細胞表面有高水平表達�����, 表明αvβ3在腫瘤生長����、侵襲和轉(zhuǎn)移過程中起著關(guān)鍵作用。
03雙靶向FAP和αvβ3的18F-LNC1007注射液可以進一步提高腫瘤的診斷效率����,在臨床前研究和臨床轉(zhuǎn)化研究中,18F-LNC1007注射液能夠顯著延長腫瘤攝取時間����、提升腫瘤靶向效率�����,并具有良好的腫瘤成像質(zhì)量。有希望在未來成為一種非侵入性示蹤劑用于FAP和/或αvβ3陽性表達患者的臨床診斷����。
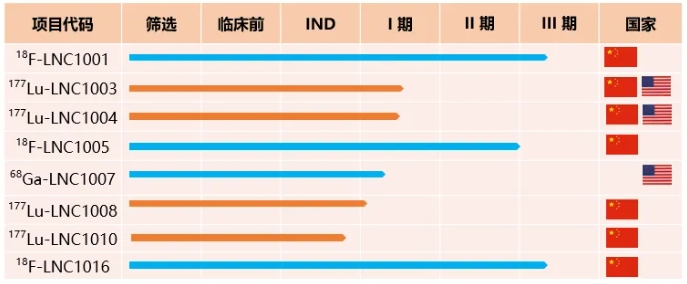
藍納成迄今已有涉及4個靶點共9款診療一體化創(chuàng)新核藥����,在中美分別處于臨床試驗或IND審評階段����,共計獲得13項臨床試驗批件;5款診斷核藥:2款處于III期臨床試驗����,2款處于I期臨床研究階段;4款治療核藥:3款處于I期臨床研究階段����,1款處于IND審評階段。
關(guān)于藍納成
藍納成是由東誠藥業(yè)與國際頂級分子影像及納米醫(yī)學領(lǐng)域?qū)<谊愋≡淌谟?021年聯(lián)合創(chuàng)立的�����,專注于全球領(lǐng)先的1類診療一體化創(chuàng)新腫瘤核藥研發(fā)平臺的打造�����,致力于為腫瘤患者提供更加精準和有效的治療方案�����,推動核醫(yī)學在全球的發(fā)展。(煙臺藍納成生物技術(shù)有限公司網(wǎng)址:https://www.dc-lnc.com/)






 新聞中心
新聞中心





 集團微信公眾號
集團微信公眾號
 集團招聘平臺
集團招聘平臺
