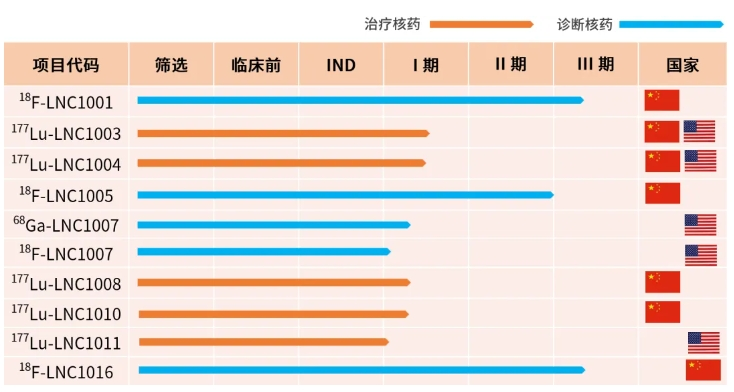
6月28日�����,東誠藥業(yè)集團(tuán)下屬公司藍(lán)納成收到美國食品藥品監(jiān)督管理局核準(zhǔn)簽發(fā)的關(guān)于177Lu-LNC1011注射液的藥品臨床試驗(yàn)批準(zhǔn)通知書����,將于近期開展 I 期臨床試驗(yàn)。
經(jīng)查詢公開資料�����,目前全球僅有諾華公司的同靶點(diǎn)藥物 Pluvicto 上市����,2023 年 Pluvicto 銷售額為9.8億美元,2024 年一季度銷售額為4.2億美元�����。
關(guān)于177Lu-LNC1011注射液
01公司在研產(chǎn)品177Lu-LNC1011注射液是一種靶向前列腺特異性膜抗原(Prostate Specific Membrane Antigen�����, 以下簡稱“PSMA” ) 的放射性體內(nèi)治療藥物����, 擬用于治療 PSMA 陽性表達(dá)的晚期前列腺癌患者����。
02PSMA是由前列腺上皮細(xì)胞分泌的一種II型谷氨酸縮肽酶����,特異性高表達(dá)于前列腺癌及其轉(zhuǎn)移灶的細(xì)胞中�����。177Lu-LNC1011注射液在動物體內(nèi)外試驗(yàn)研究中展現(xiàn)出較高的結(jié)合親和力和PSMA靶向特異性����,使放射性核素能夠濃聚于腫瘤病灶,實(shí)現(xiàn)腫瘤的精準(zhǔn)治療����。相關(guān)的 IIT(investigator-initiated trial,研究者發(fā)起的臨床研究)研究結(jié)果表明受試者耐受性良好�����,藥品安全性高�����,在唾液腺中攝取較低����,并在腫瘤中實(shí)現(xiàn)高吸收劑量����。177Lu-LNC1011注射液初步治療效果顯著����,有望成為一種療效更好的 PSMA 靶向治療藥物。
藍(lán)納成迄今已有涉及4個(gè)靶點(diǎn)共10款診療一體化創(chuàng)新核藥����,在中美分別處于臨床試驗(yàn)或IND審評階段,共計(jì)獲得15項(xiàng)臨床試驗(yàn)批件����。5款診斷核藥中,2款處于III期臨床試驗(yàn)����,1款處于II期臨床試驗(yàn),2款處于I期臨床研究階段�����;5款治療核藥處于I期臨床研究階段�����。
關(guān)于藍(lán)納成
藍(lán)納成是由東誠藥業(yè)與國際頂級分子影像及納米醫(yī)學(xué)領(lǐng)域?qū)<谊愋≡淌谟?021年聯(lián)合創(chuàng)立的�����,專注于全球領(lǐng)先的1類診療一體化創(chuàng)新腫瘤核藥研發(fā)平臺的打造�����,致力于為腫瘤患者提供更加精準(zhǔn)和有效的治療方案�����,推動核醫(yī)學(xué)在全球的發(fā)展�����。
(煙臺藍(lán)納成生物技術(shù)有限公司網(wǎng)址:https://www.dc-lnc.com/)






 新聞中心
新聞中心





 集團(tuán)微信公眾號
集團(tuán)微信公眾號
 集團(tuán)招聘平臺
集團(tuán)招聘平臺
